我们开发了一种专有的技术平台,能够快速降解免疫球蛋白G(IgG)。该平台采用全球领先的低预存抗体IgG降解酶,通过静脉给药,能迅速且完全清除血浆和组织中的总体IgG。
IgG是人体血清中免疫球蛋白的主要成分,约占血清总蛋白总含量的10-20%。正常情况下,IgG能够保护人体免受外来病原的伤害。然而,在某些疾病状态下,如IgG型多发性骨髓瘤或由致病性IgG引起的自身免疫性疾病(如肾小球基底膜病、格林-巴利综合征、重症肌无力等),IgG是致病因素。
正常IgG也可能阻碍一些患者生命攸关的急性治疗需求。在异体或异种器官移植中,人体内的IgG会识别供体组织中的非自身抗原,激活免疫系统,导致排斥反应。在以病毒载体为基础的基因治疗中,IgG可能会中和载体使之无效。
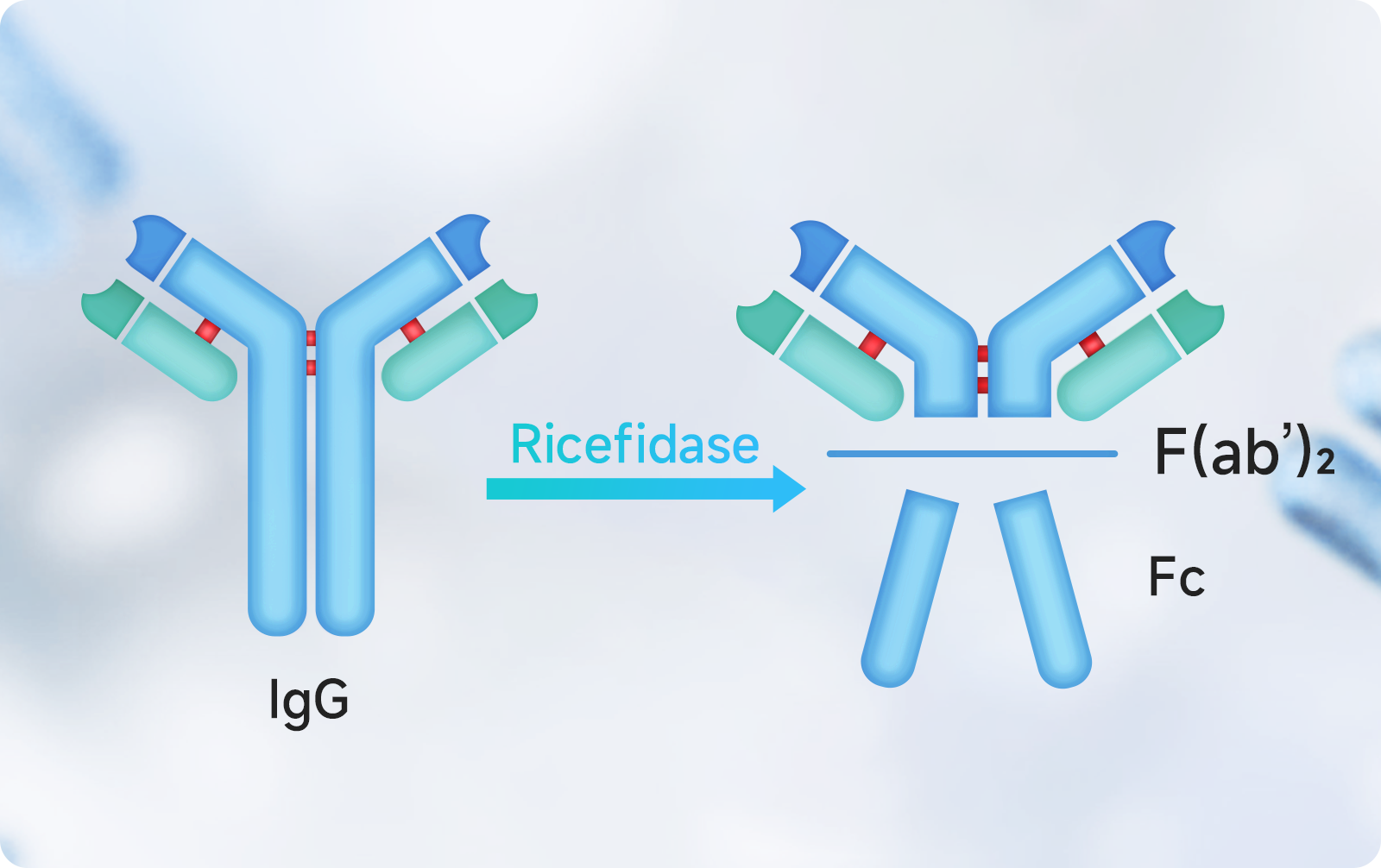
针对如此量级的致病或干扰治疗的IgG,常规医疗管理手段生效慢且昂贵。Ricefidase是全球领先的新一代IgG降解酶,它来源于不感染人类的化脓性链球菌的酶,通过我们自主研发设计改构而获得。Ricefidase能够高度特异性地降解IgG的下铰链区,使其失活。
在新西兰和中国完成的I期临床试验已经证明,在给予Ricefidase后的1到2小时,受试者血清和组织中的IgG几乎全部被酶切清除。被酶切后的片段无法介导依赖Fc的病理机制,从而防止和抑制不良免疫反应,如依赖IgG的补体激活、细胞杀伤和细胞活化等。
与人体内预存抗体高达85%以上、在欧洲获批上市的伊立菲酶相比,Ricefidase在人体内的预存抗体比例低于20%,且具有低免疫原性,因此可以与免疫抑制剂如MTX联合使用。Ricefidase还能用于增加治疗窗口期,具备更广泛的适应症潜力,例如需要重复给药的自身免疫性疾病治疗,致敏性器官移植后的维持治疗、基因治疗以及IgG型多发性骨髓瘤等肿瘤治疗。
2022年03月Ricefidase获新西兰药监(Medsafe)批准开展I期临床试验。
2022年05月Ricefidase获FDA临床试验许可,用于治疗一大类由病理性IgG导致的自身免疫性疾病。
2022年08月Ricefidase获NMPA临床试验许可,用于高度致敏的肾移植患者脱敏治疗。
2023年04月Ricefidase在中国、新西兰分别完成I期临床试验 (CTR20222595/NCT05274659)。
2024年08月Ricefidase获NMPA临床试验许可,用于抗GBM病治疗,并在中国启动抗GBM病II期临床试验(NCT06607016)。
2024年09月Ricefidase在高度致敏的肾移植患者脱敏治疗II期临床试验取得积极顶线数据(CTR20234137)。

我们的生产过程符合现行GMP要求,临床期间的生产规模满足未来商业化的需求。